אנרגית התפלה של מי-ים
אורי לכיש, גומה מדע
![]()
תקציר: חישוב האנרגיה הנמוכה ביותר הדרושה להתפלת מי-ים בתהליך תרמודינמי הפיך.
עקרונות התרמודינמיקה קובעים כי כל שיטה להתפלת מים תהיה הכי יעילה אם תתבצע
בתהליך תרמודינמי הפיך. אותה אנרגיה מושקעת בכל תהליך התפלה הפיך, והיא אינה תלוייה בפרטי הטכנולוגיה
שבה משתמשים, בפרטי המנגנון של התהליך, או במספר השלבים שלו. חישוב האנרגיה בתהליך הפיך
כלשהו, טוב לכל התהליכים ההפיכים, ואנרגיה זאת היא הגבול התחתון לכל תהליך התפלה אחר, שאינו הפיך במלואו.
אוסמוזה היא תופעה של מעבר מים דרך ממברנה חדירה למחצה, אשר חוסמת מעבר של
מלחים דרכה. לחץ חיצוני, על פני התמיסה, קובע את המהירות והכיוון של מעבר המים דרך הממברנה.
עקרונית, אוסמוזה היא תהליך הפיך,
אבל הביצוע שלה בפועל איננו הפיך לגמרי. האנרגיה של התפלת מי-ים בשיטת האוסמוזה תחושב כאן.
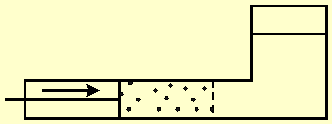
תרשים-1 מראה כלי המחולק לשני אגפים על-ידי ממברנה
חדירה למחצה. האגף השמאלי מכיל מי-ים ומחיצה דוחפת את המים דרך הממברנה. הממברנה חוסמת את מעבר המלח
ורק מים נקיים עוברים דרכה. לכן, האגף הימני של הכלי מכיל רק מים נקיים. העבודה W, שעושה המחיצה, שווה
לכח F הפועל עליה, כפול המרחק x שהיא עוברת. התהליך הפיך כי כוון תנועת המחיצה, ולכן גם כוון זרימת המים, ניתנים
להיפוך בכל רגע ורגע, על-ידי שליטה בכוח הפועל על המחיצה.
הכח הפועל על המחיצה שווה ללחץ האוסמוטי כפול בשטח שלה. הלחץ האוסמוטי
π
נתון על-ידי נוסחת (van't Hoff)
ונט-הוף
[1]:
π = cRT
כאשר
c
הריכוז המולרי של יוני המלח,
(R = 0.082 (liter∙bar) / (deg∙mol
הוא קבוע הגזים, ו-
T = 300 K
היא טמפרטורת הסביבה בסקלה של הטמפרטורה המוחלטת (קלווין, Kelvin).
יש בקרוב 33 גרם של מלחים שונים בליטר של מי-ים. אבל החישוב יהיה פשוט יותר אם נניח שהמלח היחיד הוא נתרן כלורי
(NaCl).
המשקל האטומי של נתרן הוא 23 גרם, ושל כלור הוא 35.5 גרם, כך שהמשקל המולקולרי של נתרן כלורי
NaCl
הוא 58.5 גרם. מספר המולים של נתרן כלורי NaCl
במי ים יהיה, לכן,
33 / 58.5 = 0.564 mol / liter.
מולים בליטר. (לא מוכר? ראה "יחידות ומידות כימיות").
כשמלח נתרן כלורי NaCl מתמוסס במים הוא מתפרק ליוני נתרן +Na
חיוביים וליוני כלור
-Cl שליליים. מכל מולקולה מתקבלים שני יונים ולכן ריכוז היונים הכללי יהי כפול מריכוז המולקולות.
c = 2∙0.564 = 1.128 mol / liter.
כשמציבים את הריכוז בנוסחת ונט-הוף מתקבל הלחץ האוסמוטי:
π = 1.128∙0.082∙300 = 27.8 bar
או, 27.8 קילוגרם לסנטימטר מרובע.
אם שטח החתך של המחיצה הוא סנטימטר מרובע אחד, היא צריכה לנוע
מרחק של 1000 סנטימטרים, או, 10 מטרים, כדי לדחוף ליטר אחד של מים דרך הממברנה. העבודה של תנועה זאת היא:
W = F∙x = 27.8∙1∙10 = 278 kg meter / liter
או, 2780 ג'אול לליטר, כיוון ש- 10 ג'אולים הם שווי ערך לקילוגרם-מטר אחד.
או,
W = 2780 / 3600 = 0.77 (kWatt hour) / (cubic meter)
קילוואט שעה למטר מעוקב.
קילו-קלוריה אחת היא שוות ערך ל- 4200 ג'אול בערך, לכן העבודה היא
0.66 = 4200 / 2780 קילו-קלוריות לליטר.
0.66 קילו-קלוריות לליטר היא האנרגיה המינימלית הדרושה להתפלה של ליטר אחד מי-ים בריכוז של 33 גרם מלח
בליטר. אנרגיה זאת אינה תלויה בטכנולוגיה שבה משמתמשים בתהליך ההתפלה.
מעניין להשוות אנרגיה זאת לאנרגיה הדרושה לחמם ולהרתיח ליטר אחד של מי-ים ולעבות את אדיהם. דרושות בערך 70 קילו-קלוריות
כדי לחמם את המים לטמפרטורת הרתיחה, ואז עוד 540 קילו-קלוריות להרתיח אותם. רוב החום
המושקע חוזר בתהליך העיבוי וחלק גדול ממנו ניתן לנצל מחדש על-ידי שימוש במחליפי חום. אבל
נראה שקשה להתחרות עם יעילות האנרגיה של תהליך ההתפלה הישיר באמצעות אוסמוזה הפוכה.
הפקת כמות של מים מותפלים דורשת שאיבה של כמות גדולה יותר של
מי-ים. חלק ממי הים הנשאבים הופכים למים מותפלים, וחלק מהם חוזרים לים כמים
בעלי ריכוז מלח גבוה. היחס בין כמות המים המותפלים לכמות מי הים שמהם הופקו, נקרא יחס תנובת המים.
מערכות התפלת ממשיות אף-פעם אינן הפיכות במלואן, וישנם
תמיד הפסדי אנרגיה בלתי נמנעים שנובעים מתרומה של תהליכים בלתי הפיכים. הפסדים אלו, אשר
תלויים ביחס התנובה של המים, מגדילים את האנרגיה הדרושה להתפלת המים אל מעבר למינימום של הגבול התרמודינמי.
פרטים נוספים:
Optimizing the Efficiency of Reverse Osmosis Seawater Desalination.
הערה
עבודת ההתפלה W היא:
W = F∙x = π∙A∙
x = π∙V
כאשר π
הוא הלחץ האוסמוטי
, A הוא שטח המחיצה, ו- A∙x = V הוא נפח המים שהמחיצה שואבת.
ביחידות שונות:
W = π∙V ∙100
עבור W בג'אולים (וואט-שניה), π ביחידות בַּר (קילוגרם לסנטימטר מרובע), ו- V בליטרים.
או:
W = π∙V∙(100 / 3600) =
π∙V / 36
עבור W בקילוואט שעה, π ביחידות בַּר, ו- V
במטרים מעוקבים.
עברית: מרץ 2008
אוסמוזה התפלה וקרנו
צינור מים מתוקים במקום תעלת הימים
מהם אוסמוזה אוסמוזה הפוכה ולחץ-אוסמוטי
אנרגית התפלה של מי-ים
מספר אבוגדרו משקל אטומי ומשקל מולקולרי
העיוורים והפיל
האיש הראשון שראיתי
דוליטל הרופא ומאורעותיו
נוסע המחלקה הראשונה
יהודים רוקדים
שלוש פעמים
חלוצים סוללים כביש
יום עיון
סיפורים
Facebook
References:
J.H. van't Hoff,
"Die Rolle osmotischen Drucks in der Analogie zwischen Losungen und Gasen",
Zeitschrift fur physikalische Chemie, vol 1, pp. 481-508 (1887)
J.H. van't Hoff, "The Function of Osmotic Pressure
in the Analogy between Solutions and Gases",
translated by W.
Ramsay, Philosophical Magazine, S. 5. vol 26. No. 159. Aug, pp. 81-105 (1888)
J.H. van't Hoff, "The Role of Osmotic Pressure
in the Analogy between Solutions and Gases",
in: The Modern Theory of Solution, Memoirs by Pfeffer, van't Hoff, Arrhenius, and Raoult,
translated and edited by Harry C. Jones, Harper & Brothers Publishers, New York and London, pp. 11-42 (1899)
On the net: April 2000.
See:
Osmosis Reverse Osmosis and Osmotic Pressure what they are.
Desalination machine.
By the author:
- Osmosis Desalination and Carnot, https://urila.tripod.com/Osmosis_Carnot.htm, December (2012).
- "Light Scattering", https://urila.tripod.com/scatter.htm, August (2011).
- "The Sun and the Moon a Riddle in the sky", https://urila.tripod.com/moon.htm, July (2011).
- "Osmosis and thermodynamics", American Journal of Physics, Vol 75 (11), pp. 997-998, November (2007).
- "van't Hoff's Evidence", https://urila.tripod.com/evidence.htm, October (2007).
- "Osmosis and Thermodynamics", https://urila.tripod.com/osmotic.htm, January (2007).
- "Expansion of an ideal gas", https://urila.tripod.com/expand.htm, December (2002).
- "Optimizing the Efficiency of Reverse Osmosis Seawater Desalination", https://urila.tripod.com/Seawater.htm, May (2002).
- "Boltzmann Transport Equation", https://urila.tripod.com/Boltzmann.htm, May (2002).
- "Energy of Seawater Desalination", https://urila.tripod.com/desalination.htm, April (2000).
- "Avogadro's number atomic and molecular weight", https://urila.tripod.com/mole.htm, April (2000).
- "Vapor Pressure, Boiling and Freezing Temperatures of a Solution", https://urila.tripod.com/colligative.htm, December (1998).
- "Osmosis Reverse Osmosis and Osmotic Pressure what they are", https://urila.tripod.com/index.htm, February (1998).
- "Calculation of linear coefficients in irreversible processes by kinetic arguments", American Journal of Physics, Vol 46 (11), pp. 1163-1164, November (1978).
- "Derivation of some basic properties of ideal gases and solutions from processes of elastic collisions", Journal of Chemical Education, Vol 55 (6), pp. 369-371, June (1978).
Links:
- Thermodynamics Research Laboratory, http://www.uic.edu/~mansoori/Thermodynamics.Educational.Sites_html
- Thermodynamik - Warmelehre, http://www.schulphysik.de/thermodyn.html
- The Blind Men and the Elephant
- My Spin on Lunacy
- Five Weeks in a Balloon
- The first man I saw
- "Faster, Faster!"
- Perfection can't be rushed
- The man higher up
- Brains
- The First-Class Passenger
- other